
患者招募
宫颈癌患者招募
发布时间:2022-01-14|
作者:尊龙凯时人生就是搏集团
研究背景
一项“评价SG001注射液治疗PD-L1表达阳性的复发或转移性宫颈癌患者的有效性和安全性的单臂、开放、多中心的II期临床研究”正在开展。本研究药物是由尊龙凯时人生就是搏集团中奇制药技术(石家庄)有限公司研发的重组抗PD-1 全人源单克隆抗体注射液(SG001),研究已获得了伦理委员会的批准。
本研究拟入组PD-L1表达阳性的复发或转移性宫颈癌患者,主要研究试验药物的疗效及其安全性。
入选条件
年龄≥18周岁(以签署知情同意书当天为准)且自愿签署知情同意书者。
经组织学确认的复发或转移性宫颈癌(病理类型包括鳞状细胞癌、腺癌及腺鳞癌),并需提供病理报告。
接受过一线含铂化疗失败或者不能耐受的复发或转移性宫颈癌患者。
肿瘤标本检测PD-L1表达阳性(CPS≥1);
根据实体瘤疗效评价标准(RECIST v1.1),受试者至少有一个CT或MRI确认的可测量病灶;可测量病灶应未接受过放疗等局部治疗(位于既往放疗区域内的病灶,如果证实发生进展,也可选做靶病灶)。
受试者如过去曾接受过抗肿瘤治疗,应在以往治疗的毒性反应NCI-CTCAE 5.0等级评分≤ 1级(除残留的脱发效应、疲劳)后才可入组。
ECOG评分体能状态为0或1的受试者。
根据研究者判断,预计生存期≥3个月者。
重要器官功能符合下列要求:
a. 血常规(首次给药前14天内未输血、未使用造血刺激因子、以及未使用其他药物纠正血细胞数):中性粒细胞计数 ANC ≥1.5×109/L;血小板计数PLT ≥75×109/L;血红蛋白HGB ≥9 g/dL。
b.血生化:血清肌酐Cr≤1.5×ULN或肌酐清除率CCr≥50mL/min;总胆红素TBIL ≤1.5×ULN(Gilbert’s综合征受试者可放宽至3×ULN );丙氨酸氨基转移酶ALT (SGPT)和天门冬氨酸氨基转移酶AST (SGOT)≤2.5×ULN(肝转移受试者≤5×ULN)。
c.凝血功能:活化部分凝血活酶时间(APTT)和国际标准化比率(INR)≤1.5×ULN(首次给药前14天内未使用抗凝药物或其他影响凝血功能的药物纠正,除外因受试者疾病需要长期使用抗凝药物的情况)。
育龄期妇女必须同意从签署知情同意书开始至末次给药后6个月内采取足够的避孕措施。
联系方式
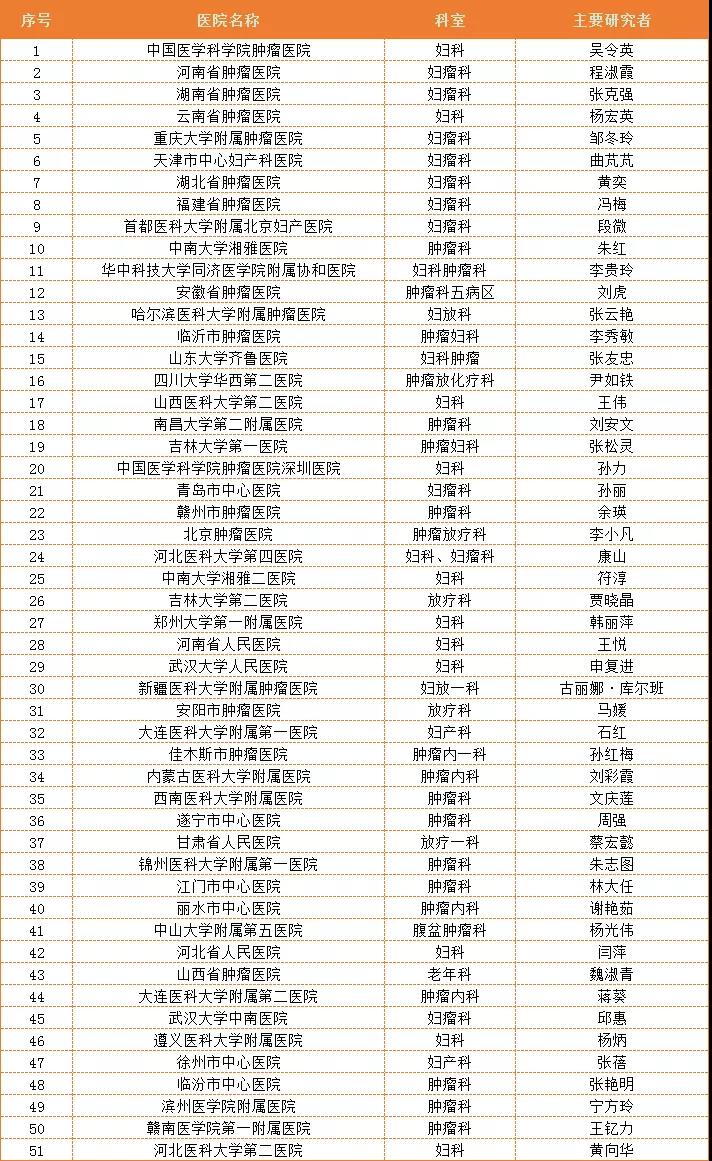
以下是本研究的所有参研单位,如有意向,可到院垂询!
一项“评价SG001注射液治疗PD-L1表达阳性的复发或转移性宫颈癌患者的有效性和安全性的单臂、开放、多中心的II期临床研究”正在开展。本研究药物是由尊龙凯时人生就是搏集团中奇制药技术(石家庄)有限公司研发的重组抗PD-1 全人源单克隆抗体注射液(SG001),研究已获得了伦理委员会的批准。
本研究拟入组PD-L1表达阳性的复发或转移性宫颈癌患者,主要研究试验药物的疗效及其安全性。
入选条件
年龄≥18周岁(以签署知情同意书当天为准)且自愿签署知情同意书者。
经组织学确认的复发或转移性宫颈癌(病理类型包括鳞状细胞癌、腺癌及腺鳞癌),并需提供病理报告。
接受过一线含铂化疗失败或者不能耐受的复发或转移性宫颈癌患者。
肿瘤标本检测PD-L1表达阳性(CPS≥1);
根据实体瘤疗效评价标准(RECIST v1.1),受试者至少有一个CT或MRI确认的可测量病灶;可测量病灶应未接受过放疗等局部治疗(位于既往放疗区域内的病灶,如果证实发生进展,也可选做靶病灶)。
受试者如过去曾接受过抗肿瘤治疗,应在以往治疗的毒性反应NCI-CTCAE 5.0等级评分≤ 1级(除残留的脱发效应、疲劳)后才可入组。
ECOG评分体能状态为0或1的受试者。
根据研究者判断,预计生存期≥3个月者。
重要器官功能符合下列要求:
a. 血常规(首次给药前14天内未输血、未使用造血刺激因子、以及未使用其他药物纠正血细胞数):中性粒细胞计数 ANC ≥1.5×109/L;血小板计数PLT ≥75×109/L;血红蛋白HGB ≥9 g/dL。
b.血生化:血清肌酐Cr≤1.5×ULN或肌酐清除率CCr≥50mL/min;总胆红素TBIL ≤1.5×ULN(Gilbert’s综合征受试者可放宽至3×ULN );丙氨酸氨基转移酶ALT (SGPT)和天门冬氨酸氨基转移酶AST (SGOT)≤2.5×ULN(肝转移受试者≤5×ULN)。
c.凝血功能:活化部分凝血活酶时间(APTT)和国际标准化比率(INR)≤1.5×ULN(首次给药前14天内未使用抗凝药物或其他影响凝血功能的药物纠正,除外因受试者疾病需要长期使用抗凝药物的情况)。
育龄期妇女必须同意从签署知情同意书开始至末次给药后6个月内采取足够的避孕措施。
联系方式
以下是本研究的所有参研单位,如有意向,可到院垂询!







